Collaborazione tra STERIS VHP e ChargePoint: caso studio relativo a Ritedose Corporation
Principali conclusioni:
- Ritedose ha utilizzato la valvola AseptiSafe® Bio di ChargePoint con il sistema STERIS VHP™ per il trasferimento sterile di polvere in una camera bianca di grado C, evitando costose modifiche infrastrutturali.
- È stata ottenuta una riduzione convalidata di 6 log tramite un ciclo in quattro fasi (deumidificazione, condizionamento, decontaminazione e aerazione), garantendo la sterilità nel punto di trasferimento.
- La soluzione integrata ha eliminato la necessità di isolatori o RABS, riducendo i costi, il consumo di energia e la complessità.
- I metodi di convalida includevano indicatori chimici e biologici, terreni di coltura e studi sul mantenimento della sterilità.
- Il sistema ha migliorato l'efficienza dei processi, la garanzia della sterilità e l'ergonomia, dimostrando vantaggi scalabili per la produzione farmaceutica.
Ritedose Corporation è un’organizzazione di sviluppo e produzione a contratto (Contract Development and Manufacturing Organization, CDMO) statunitense che produce prodotti sterili in dose unitaria.
Ritedose è un'azienda farmaceutica che offre servizi completi servendosi della tecnologia blow-fill-seal (soffiaggio, riempimento e sigillatura). Le sue capacità vanno ben oltre la produzione: si avvale, infatti, di un team interno addetto alle attività di sviluppo, con competenze specifiche in tutti gli aspetti legati all'immissione di un prodotto sul mercato, dai lotti su scala di laboratorio, alle pratiche normative, alla produzione su larga scala e alla distribuzione. Vanta oltre 20 anni di esperienza nella produzione di prodotti per la respirazione e l’oftalmologia e uno stabilimento, in grado di produrre 1,7 miliardi di unità, che sfrutta le più recenti tecnologie in termini di formulazione, blow-fill-seal e confezionamento ad alta velocità.
La sfida da affrontare
Ritedose Corporation intendeva risolvere il problema relativo all’introduzione del principio attivo farmaceutico (Active Pharmaceutical Ingredient, API) sterile in un serbatoio di miscelazione. Si tratta di un problema comune che si presenta con tutti i prodotti farmaceutici preparati in modo asettico.
Ai fini del processo era fondamentale mantenere condizioni sterili durante l'aggancio del contenitore al recipiente e il successivo trasferimento dell’API solido per ottenere una sospensione liquida. Se il liquido fosse completamente disciolto, il prodotto potrebbe essere filtrato in modo sterile per preservare la condizione di sterilità durante il trasferimento nella riempitrice. Tuttavia, poiché in questo caso il prodotto trasferito nella riempitrice era una sospensione, questa opzione non era possibile.
Tale condizione rendeva necessaria l’esecuzione dell’intero processo in condizioni asettiche e, di conseguenza, la necessità di ricorrere ad una delle seguenti migliorie:
1. Intervento a livello dell'intera camera, passando da una camera bianca di grado C a una di grado A.
2. Intervento a livello della camera, dotandola di un ambiente di grado B e introducendo un'area di grado A con sovrapressione attorno al punto di riempimento.
3. Intervento a livello della camera, dotandola di un ambiente di grado B e introducendo un sistema di barriera ad accesso limitato (Restricted Access Barrier System, RABS) nel punto di riempimento o nel recipiente pieno.
4. Mantenimento della camera bianca di grado C, introducendo però la tecnologia con isolatore attorno al punto di riempimento o al recipiente pieno.
Solitamente, in un caso come questo si sarebbe preferito utilizzare il RABS e la tecnologia con isolatore per i vantaggi che apportano in termini di migliore garanzia di sterilità, impiegando le tecniche fondamentali di separazione e decontaminazione. Tuttavia, considerando alcuni degli aspetti svantaggiosi associati a queste tecnologie, come l'elevato investimento di capitale iniziale, lo spazio, l'ergonomia, i costi e consumi energetici continui, l'azienda ha deciso di ricercare una soluzione più adatta a questa delicata attività.
La soluzione
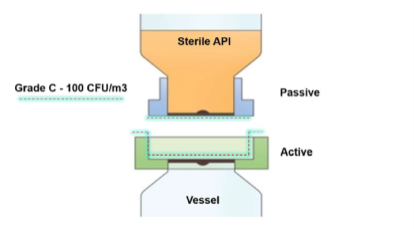
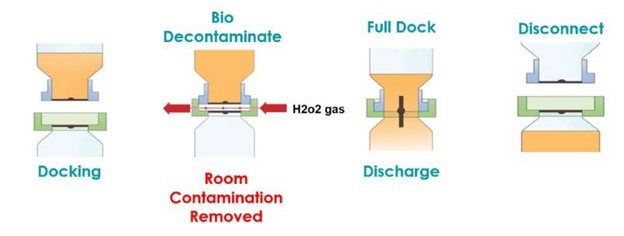
Come soluzione ideale a questo problema è stata scelta una biovalvola asettica, che offre un sistema di trasferimento della polvere sigillato con un ingombro ridotto, montato sulla porta di ingresso del recipiente. A differenza delle tradizionali valvole a farfalla split (Split Butterfly Valve, SBV) o di altri connessioni convenzionali, la valvola può essere presterilizzata a vapore insieme al recipiente (vedere Figura 1a/b). Durante il collegamento finale è stata anche rimossa l’eventuale contaminazione ambientale dalle superfici di accoppiamento del trasferimento secondo una modalità controllata e convalidata (vedere Figura 2a/b).

Figura 1a: tappo SIP in sede di aggancio

Figura 1b: SIP attraverso il tappo – presterilizzazione attiva e recipiente
Trasferimento sterile dell’API
La valvola AseptiSafe Bio funziona creando una camera sigillata tra il contenitore di trasferimento (sezione passiva) e il recipiente (sezione attiva). Quando le due metà si agganciano, la camera sigillata si decontamina biologicamente mediante un sistema di biodecontaminazione con perossido d’idrogeno vaporizzato (VHP®) di STERIS.
Figura 2a

L'unità STERIS VHP rimuove qualsiasi contaminazione biologica raggiungendo una riduzione convalidata di 6 log e garantendo la decontaminazione dello spazio e delle superfici di accoppiamento, che saranno così pronte ad agganciarsi completamente. Una volta completato l’accoppiamento, il disco potrà essere aperto, consentendo il passaggio del prodotto dal contenitore di trasferimento al recipiente, senza alcun rischio di contaminazione. Il trasferimento all'interno dello spazio di grado C ha comportato enormi vantaggi in termini di costi e produzione, sebbene sia stato necessario convalidare in toto il processo per garantire che i vantaggi iniziali percepiti potessero essere dimostrati.
Figura 2b
Convalida
Il primo passo per la convalida microbiologica del processo è stato generare un ciclo di decontaminazione convalidato per la fase di gassificazione con perossido d’idrogeno. Il processo gassoso a secco di STERIS VHP è costituito da quattro fasi distinte, che verranno eseguite dal generatore per garantire il rispetto di tutte le condizioni fondamentali e l’esecuzione in ogni occasione di un ciclo convalidato. Tutte e quattro le fasi sono programmate nei tempi previsti.
1. Deumidificazione: riduzione dell’umidità da parte della valvola sottoposta a gassificazione all'interno della camera in modo da creare le condizioni ideali per l'eliminazione biologica.
2 Condizionamento: introduzione del VHP nella valvola per raggiungere livelli tali da ottenere una buona decontaminazione.
3 Decontaminazione: mantenimento della concentrazione di VHP per eliminare qualsiasi attività microbiologica all'interno della valvola.
4. Aerazione: rimozione del VHP dal sistema al termine della decontaminazione biologica in modo che non rimangano livelli di residui nocivi. Normalmente il livello di accettazione è di 1 ppm, anche se in questo caso è stato utilizzato un livello di accettazione pari a 0,4 ppm. Ritedose ha utilizzato un limite di residui inferiore per garantire un sistema robusto e impedire il rischio di contaminazione del prodotto dovuto a residui di gas.
Il ciclo completo di decontaminazione può essere eseguito in appena quattro minuti, anche se in genere ne sono necessari 20. Per questa applicazione, il processo veniva eseguito solo una volta al giorno e, per garantire la solidità del ciclo, è stata prolungata la durata di ciascuna fase critica, garantendo la conferma della decontaminazione e l’aerazione del gas dal sistema. Pertanto, il ciclo completo veniva eseguito in 41 minuti (dal condizionamento all’aerazione).
Parametro/Fase | Deumidificazione | Condizionamento | Decontaminazione | Aerazione |
Tempo, min | 10 | 0 | 6 | 25 |
Nei cicli iniziali sono stati utilizzati indicatori chimici (IC) per stabilire la distribuzione di H202. Una volta ottenuti risultati soddisfacenti con gli IC, sono stati introdotti nel processo indicatori biologici (IB) per confermarne la buona riuscita. Al termine di ogni ciclo sono stati raccolti tutti gli IB e gli IC. Sono state quindi controllate le strisce di indicatori chimici per verificare il cambiamento di colore e garantire una distribuzione uniforme del vapore. Gli IB sono stati trasferiti su un terreno di coltura adatto, in questo caso il terreno di coltura Spordex®, e incubati a una temperatura compresa tra 55 °C e 60 °C per sette giorni. Sono stati osservati quotidianamente per verificare l'eventuale crescita microbica.

I criteri di accettazione per il ciclo erano i seguenti:
A) Tutte le strisce di IC utilizzate nel ciclo dovevano aver cambiato colore.
B) L'IB del controllo positivo doveva mostrare una crescita.
C) Almeno un IB di ogni sito non doveva mostrare una crescita.
Una volta sviluppato il ciclo, è stato eseguito in triplicato per definire la qualificazione delle prestazioni (Performance Qualification, PQ) per questo elemento del processo.
Per convalidare il sistema nella sua totalità, il processo è stato testato con più terreni prima della convalida. Questi test con i terreni, risultati soddisfacenti, sono poi proseguiti con tre terreni alla PQ. La tenuta sterile è stata dimostrata per più di 10 giorni con il prodotto trasferito nel recipiente e con la biovalvola tenuta in posizione chiusa e interbloccata. È stato dimostrato che il periodo di mantenimento della sterilità per la sezione passiva (prodotto nel contenitore di trasferimento) si è protratto per 48 ore, un risultato più che soddisfacente considerando che solitamente si raggiunge la metà del tempo.
Conclusione
L'installazione è ora operativa e in piena produzione. Ai vantaggi iniziali riscontrati all'esordio del progetto, quali bassi costi per l’acquisto delle apparecchiature, ingombro ridotto e facilità di installazione, si aggiungono ora una migliore garanzia di sterilità, semplicità d'uso per gli operatori e ridotta manutenzione. Il sistema è semplice da usare, facile da installare/convalidare e ha sicuramente migliorato i processi aziendali.
Le conoscenze apprese in questo progetto riguardano la fase di dispensazione. Al momento della convalida, il sistema installato era una soluzione riutilizzabile completamente rigida in cui l'API presterilizzato veniva fornito a Ritedose in sacchetti, i quali venivano aperti e quindi suddivisi e dispensati all'interno di un isolatore asettico nel contenitore di trasferimento pre-autoclavato e nella sezione passiva della biovalvola. Sarebbe stato utile sterilizzare il prodotto, il contenitore e la connessione di trasferimento in un'unica fase (irradiazione gamma); tuttavia, ciò non è stato possibile a causa dei vincoli associati alla sterilizzazione con raggi gamma di insiemi di componenti in acciaio inossidabile ed elastomerici sotto forma di un unico elemento.
Questa soluzione è ora messa a disposizione da ChargePoint sotto forma di elemento passivo monouso (Single Use Passive, SUP)/ChargeBag® e in futuro potrebbe essere adottata per migliorare e semplificare il processo. Di conseguenza, si potrebbe sterilizzare tramite raggi gamma l'intera confezione (sacchetto ed elemento passivo), anziché dover effettuare più fasi di sterilizzazione individuali e di assemblaggio asettico.
"Era fondamentale scegliere la soluzione giusta per questo progetto, per evitare la contaminazione del prodotto e costose perdite produttive. Abbiamo scelto la valvola di trasferimento ChargePoint AseptiSafe® Bio perché garantisce una maggiore sterilità durante la manipolazione di ingredienti sensibili come la nostra sostanza farmacologica. Abbiamo ricevuto un notevole supporto durante il progetto e stiamo beneficiando di significative riduzioni dei costi e di processi efficienti."
Angie Koen, Vicepresidente dei servizi tecnici, The Ritedose Corporation.
Contenuti consigliati
Guida all'implementazione di un sistema con VHP per la biodecontaminazione delle strutture
Scegliere la tecnologia di decontaminazione: perossido d’idrogeno aerosolizzato o VHP
I vantaggi della decontaminazione con perossido d'idrogeno vaporizzato
Iscriviti alla nostra mailing list per ricevere le ultime novità del settore e gli aggiornamenti sui prodotti.
Cliccando su Iscrizione confermi di accettare i nostri Termini e condizioni.



